
Descripción de la experiencia:
Se trata de una experiencia que parte del experimento histórico en torno a la reacción de síntesis y análisis del compuesto conocido como mercurius
praecipitatus per se (el cual tuvo una gran relevancia en la Revolución Química de finales del siglo XVIII) para diseñar una experiencia didáctica para el aprendizaje significativo,
contextualizado y experimental de los fundamentos de la reactividad química.
Marco curricular:
Esta experiencia ha sido diseñada para la materia de Física y Química de 4.º ESO.
Objetivos didácticos:
La experiencia didáctica pretende que el alumnado:
-
Desarrolle su capacidad de observación como una destreza científica básica.
- Reflexione sobre la relación y no siempre sencillo acomodo entre los hechos experimentales y las teorías científicas, valorando así la naturaleza empírica y provisional del conocimiento científico.
-
Conozca algunos hitos de la historia de la química, como la Revolución Química del siglo XVIII, extrayendo lecciones sobre la naturaleza de la química como
ciencia, con especial atención a su carácter colectivo.
-
Aplique conceptos fundamentales de la reactividad química, como la ley de conservación de la masa, los cálculos estequiométricos, los tipos de reacciones
químicas y su representación atómico-molecular y simbólica.
- Se inicie en el aprendizaje de las reacciones redox, vinculando el concepto de número de oxidación o valencia aprendido al abordar la formulación y nomenclatura inorgánica con los aprendizajes sobre reactividad química.
- Reconozca la reversibilidad de algunos procesos químicos.
-
Respete las medidas de seguridad en el laboratorio y se informe sobre la toxicidad de algunas sustancias químicas, como el mercurio.
Pautas para el desarrollo de la actividad:

El experimento histórico
En el libro "La revolución química. Entre la historia y la memoria", los historiadores de la ciencia José Ramón Bertomeu Sánchez y Antonio García Belmar ofrecen una detallada explicación de los experimentos con el mercurius praecipitatus per se y sus implicaciones en la Revolución Química. Mercurius praecipitatus per se significa literalmente "mercurio precipitado por sí mismo". Con este nombre se designaba en el siglo XVIII al hoy conocido óxido de mercurio(II) o monóxido de mercurio (HgO). Este compuesto era descrito como una cal roja de mercurio que al calentarse daba lugar al líquido metal.
El químico francés Nicolás Lémery (1645-1715) señaló que la cal roja de mercurio podía utilizarse como laxante y en el tratamiento de varias enfermedades, como la viruela. El mismo Lémery apuntó que su síntesis era costosa, ya que se requería calentar mercurio durante meses para que "los corpúsculos de fuego" lograsen penetrar en el metal. Las dificultades en la producción de este óxido y la rápida descomposición térmica de este en mercurio llegaron a muchos químicos de la época a pensar que el mercurio, al igual que otros metales nobles como el oro y la plata, no formaba auténticas cales (hoy, óxidos) al calentarse.
En aquella época los procesos de calcinación se explicaban recurriendo a la teoría alquímica del flogisto de George Ernst Stahl (1660-1734), quien a su vez la formuló a partir de los trabajos de su mentor Johann J. Becher (1635-1682). Según esta teoría cuando un metal se calcina libera un misterioso ente o fluido conocido como flogisto. Para que la cal diera lugar de nuevo al metal sería necesario suministrarle flogisto, el cual podía proceder bien de la llama o bien de sustancias ricas en flogisto (un ejemplo serían los combustibles, como el carbón). El químico francés Louis Bernard Guyton de Morveau (1737-1816) logró obtener mercurio metálico a partir del mercurius praecipitatus per se recurriendo a un sistema de lentes para calentar la cal usando la luz solar, lo que llevó a pensar que la propia luz estaba relacionada con el flogisto.

El estudio del análisis de cales como el mercurius praecipitatus per se también fue abordado por el célebre químico inglés Joseph Priestley (1733-1804), quien puso especial atención al "aire" generado como consecuencia de su descomposición térmica. Así, observó que al calentar la cal roja de mercurio se producía "un aire" capaz de avivar vigorosamente la llama de una vela y que, al ser respirado, producía una sensación en los pulmones más intensas que el aire común. Priestley lo denominó "aire desflogisticado", ya que si era capaz de favorecer la combustión era porque era capaz de aceptar el flogisto liberado por el combustible al arder. Priestley visitó al celebérrimo químico francés Antoine Laurent Lavoisier (1743-1794) en el otoño de 1774, lo que impulsó al francés a centrar su atención en el caso del mercurius praecipitatus per se.
En un principio Lavoisier pensó que la cal roja de mercurio era en realidad una combinación de mercurio con aire fijo, gas estudiado previamente por el químico inglés James Black (1728-1799). Para comprobar la validez de su hipótesis, realizó varios experimentos:
- Al someter a la cal roja de mercurio a calentamiento sin carbón obtuvo "un aire" con propiedades análogas al aire desflogisticado de Priestley: avivaba las llamas de las velas, dotaba de vigor a los animales que lo respiraban y no daba sabor ácido al agua, en la que se recogía con gran dificultad. Lavoisier lo denominó "aire más puro que el aire".
-
Al someter a la cal roja de mercurio a calentamiento con carbón obtuvo "un aire" con propiedades análogas al aire fijo de Black: extinguía las velas, provocaba
la muerte de animales, precipitaba el agua de cal, se combinaba con álcalis (eliminando su causticidad) y se disolvía en agua dotándola de un sabor ácido.


Estas experiencias llevaron a Lavoisier y su fiel ayudante, su esposa Marie Anne P. Paulze (1758-1836), a iniciar en abril de 1776 una investigación que pasará a
convertirse en un experimento clásico de la historia de la química. Dicha experiencia fue incluida en el Traité Élémentaire de Chimie (1789), obra en la que Lavoisier recopiló sus
principales contribuciones a la química con la ayuda de Marie Anne, que realizó maravillosas ilustraciones de los experimentos, un aspecto que terminó resultando fundamental para la divulgación y
reproducibilidad de las experiencias de Lavoisier en la época y tras su muerte. El resumen de la experiencia se recoge en la siguiente imagen:
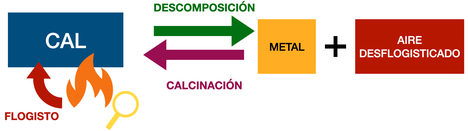
Según la teoría del flogisto, este experimento se explicaba considerando que el mercurio metálico (como todos los metales) estaba formado por la correspondiente cal (o tierra vitrificable) y flogisto.

A tenor de estos y otros experimentos y de no pocas cavilaciones y disputas, Lavoisier abogó por prescindir de la teoría del flogisto y considerar los procesos de síntesis y análisis de las cales (como la cal roja de mercurio) como procesos en los que no se intercambia flogisto, sino oxígeno (del griego, "generador de ácidos"). Este oxígeno sería, asimismo, uno de los componentes del aire común. Fue llamado así por el propio Lavoisier, quien consideraba que era el responsable de la acidez de las sustancias. Aunque en este punto estuvo errado, su explicación de la calcinación como una reacción química en la que el metal y el oxígeno del aire se combinaban entre sí permitió explicar los tres experimentos anteriores, ya que:
-
En el experimento 1, la clave no era que la cal (óxido) absorbía flogisto del fuego o de la luz, sino que liberaba oxígeno. Las cales metálicas eran por tanto
compuestos formados por oxígeno y un elemento metálico.

-
En el experimento 2, la clave no era que el carbón donase flogisto al metal, sino que la cal (óxido) liberaba oxígeno que se combinaba con el carbono presente
en el carbón para formar el aire fijo. El aire fijo de Black era, por tanto, un compuesto de oxígeno y carbono. Más tarde se descubrió que se trataba del dióxido de carbono.

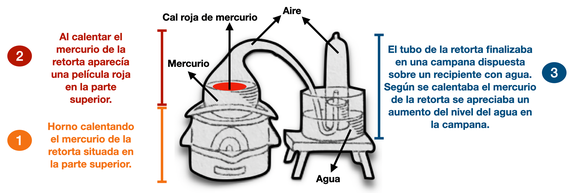
- En el experimento 3 se formaba la cal roja de mercurio por reacción del mercurio metálico de la retorta con el oxígeno contenido en el aire del interior de la misma. Al consumirse el oxígeno, se generaba un vacío parcial que permite explicar el ascenso del nivel del agua en la campana (ya que la presión en el interior se hace menor que la presión atmosférica).

Un aspecto cuantitativo reseñable de estos experimentos es el hecho de que las cales tuviesen una mayor masa que sus respectivos metales. Si la cal absorbía
flogisto para formar un metal (pues cal + flogisto = metal), ¿cómo explicar que la masa del metal formado fuese menor que la de la cal de partida? Este hecho cuantitativo fue justificado por
algunos defensores de la teoría del flogisto aludiendo a que el flogisto podía tener peso negativo o que podía dotar de cierto "carácter liviano" a las sustancias que lo contienen. Este, unido al
papel pasivo que la teoría del flogisto otorgaba al aire y al descubrimiento de sus componentes, terminaron por relegar esta teoría al olvido frente a la propuesta de Lavoisier que permitía
interpretar y explicar cuantitativamente de forma más eficiente y predictiva los procesos de oxidación como la calcinación, la combustión y la respiración.

El experimento didáctico
En el laboratorio escolar es posible realizar la recreación didáctica de los experimentos con el mercurius praecipitatus per se. Para realizar la experiencia basta con disponer unos pocos miligramos de este óxido (disponible comercialmente) y una pequeña pieza de aluminio en el interior de un tubo de ensayo que se calienta haciendo uso de un mechero Bunsen.

La reacción es de interés por permitir introducir de forma sencilla el concepto de oxidación y reducción. Se trata de una reacción endotérmica favorecida
termodinámicamente a altas temperaturas.
El vídeo de la experiencia se encuentra disponible en:
La introducción de la pieza de aluminio supone una innovación respecto a la experiencia original y tiene por objetivo comprobar de forma segura la formación de mercurio, ya que el mercurio generado por descomposición térmica del HgO forma in situ una amalgama con el aluminio. Esto permite explicar que dicha pieza "engorde" y el polvo de HgO desaparezca según se desarrolla la reacción.
Además, conociendo la masa inicial de HgO y determinando la variación de masa de la pieza de aluminio (previamente pesada), se puede determinar la cantidad de
mercurio generada y el rendimiento de la reacción, teniendo en cuenta que no todo el mercurio generado forma amalgama con el aluminio; sino que una parte del mercurio se encuentra en forma de
vapor. Esto se aprecia por formación de un espejo metálico en las paredes del tubo de ensayo.
Otra variante de este experimento consiste en repetir el proceso de calentamiento sin aluminio. En este caso puede apreciarse la reversibilidad del proceso, ya que
una vez cesa el calentamiento del mercurius praecipitatus per se, este mismo recupera su color original. En este caso la formación del mercurio metálico se observa únicamente por la
formación del espejo de mercurio en las paredes del tubo de ensayo.
Todos estos aspectos se pueden apreciar en el siguiente vídeo:
Debido a la formación de vapores de mercurio (que, aunque se trabaja con cantidades muy pequeñas, son tóxicos), se debe realizar esta experiencia con campana extractora de gases o, en su ausencia, en una zona con abundante ventilación y cerrando el extremo abierto del tubo. También se deben usar guantes, gafas protectoras, bata y mascarilla. Cabe destacar que si se cierra el extremo del tubo con un globo, es posible recoger el oxígeno liberado en el proceso. Si se libera el gas cerca de una vela, podrá observarse (como hicieron Priestley y Lavoisier) que la llama se aviva.
Materiales docentes
Este experimento histórico reconvertido en experimento didáctico puede introducirse en el aula como una experiencia de cátedra por parte del docente (dada las
precauciones que deben seguirse al trabajar con mercurio) seguida de una serie de actividades que conforman una secuencia de aprendizaje que combina el enfoque contextualizado y competencial de
la enseñanza de la ciencia y la reflexión sobre la naturaleza de la ciencia.
Otros recursos de interés
- Página web con información y recursos sobre la Revolución Química del Instituto de Historia de la Medicina y de la Ciencia "López Piñero" de la Universitat de València.
- Número monográfico de la Revista Mètode sobre la Revolución Química.
-
Vídeo
(en castellano) del curso Introducción a la Historia de la Química de la UNED dedicado a la Revolución Química.
- Vídeo (en inglés, con subtítulos en castellano) de OpenMind sobre Lavoisier y el origen de la química moderna.
- Base de datos (en inglés y francés) con abundante información y variada documentación sobre Antoine Laurent Lavoisier (1743-1794).
- Biografía de Antoine Laurent Lavoisier (1743-1794) en formato póster y en formato tríptico publicada en la web de recursos Fisiquímicamente.
- Entrada del Rincón Educativo del Foro Nuclear con información biográfica sobre Marie Anne P. Paulze (1758-1836).
- Entrada dedicada al mercurio en la tabla periódica interactiva de la Real Sociedad Española de Química.
Información adicional:

Esta experiencia fue presentada en el VIII Congreso Internacional de Docentes de Ciencia y Tecnología (Madrid, 2024). La presentación empleada en la ponencia está
disponible en este enlace.



